I risultati di questa nuova indagine mostrano la presenza di particolato micro e nano-dimensioni composto da elementi inorganici nei campioni di vaccini che non è dichiarato tra i componenti e la cui presenza indebitamente è, per il momento, inspiegabile.
Antonietta M Gatti, 1,2 Stefano Montanari 3
1 Consiglio Nazionale delle Ricerche in Italia, Istituto per la Scienza e la Tecnologia della Ceramica, Italia
2 International Clean Water Institute, USA
3 Nanodiagnostics srl, Italy
2 International Clean Water Institute, USA
3 Nanodiagnostics srl, Italy
Corrispondenza: Dott.ssa Antonietta Gatti, Consiglio Nazionale delle Ricerche d'Italia, c / o Nanodiagnostica Via E. Fermi, 1 / L, 41057 San Vito (MO), Italia, Tel 59798778
Ricevuto: 30 novembre 2016 | Pubblicato: 23 gennaio 2017
Citazione: Gatti AM, Montanari S (2016) Nuove indagini di controllo qualità sui vaccini: micro e nanocontaminazione. Vaccini Int J Vaccino 4 (1): 00072. DOI: 10.15406 / ijvv.2017.04.00072
Corrispondenza: Dott.ssa Antonietta Gatti, Consiglio Nazionale delle Ricerche d'Italia, c / o Nanodiagnostica Via E. Fermi, 1 / L, 41057 San Vito (MO), Italia, Tel 59798778
Ricevuto: 30 novembre 2016 | Pubblicato: 23 gennaio 2017
Citazione: Gatti AM, Montanari S (2016) Nuove indagini di controllo qualità sui vaccini: micro e nanocontaminazione. Vaccini Int J Vaccino 4 (1): 00072. DOI: 10.15406 / ijvv.2017.04.00072
Astratto
I vaccini sono sotto inchiesta per i possibili effetti collaterali che possono causare. Al fine di fornire nuove informazioni, è stato applicato un metodo di indagine al microscopio elettronico allo studio dei vaccini, finalizzato alla verifica della presenza di contaminanti solidi mediante un microscopio elettronico a scansione ambientale dotato di una microsonda a raggi X. I risultati di questa nuova indagine mostrano la presenza di particolato micro e nano-dimensioni composto da elementi inorganici nei campioni di vaccini che non è dichiarato tra i componenti e la cui presenza indebitamente è, per il momento, inspiegabile. Una parte considerevole di questi contaminanti da particolato è già stata verificata in altre matrici e riportata in letteratura come non biodegradabile e non biocompatibile.
Parole chiave: vaccino; Malattia; Contaminazione; Corona proteica; biocompatibilità; Tossicità; Nano particella; immunogenicità; Corpo estraneo; Ambiente; Processo industriale; Controllo di qualità
I vaccini sono sotto inchiesta per i possibili effetti collaterali che possono causare. Al fine di fornire nuove informazioni, è stato applicato un metodo di indagine al microscopio elettronico allo studio dei vaccini, finalizzato alla verifica della presenza di contaminanti solidi mediante un microscopio elettronico a scansione ambientale dotato di una microsonda a raggi X. I risultati di questa nuova indagine mostrano la presenza di particolato micro e nano-dimensioni composto da elementi inorganici nei campioni di vaccini che non è dichiarato tra i componenti e la cui presenza indebitamente è, per il momento, inspiegabile. Una parte considerevole di questi contaminanti da particolato è già stata verificata in altre matrici e riportata in letteratura come non biodegradabile e non biocompatibile.
Parole chiave: vaccino; Malattia; Contaminazione; Corona proteica; biocompatibilità; Tossicità; Nano particella; immunogenicità; Corpo estraneo; Ambiente; Processo industriale; Controllo di qualità
introduzione
I vaccini sono una delle invenzioni più importanti intese a proteggere le persone dalle malattie infettive. La pratica della varietà è vecchia di secoli ed è menzionata in documenti cinesi e indiani risalenti al 1000 d.C. Nel corso del tempo, la varietà è stata sostituita dalla vaccinazione, i vaccini sono stati migliorati in termini di tecnologia e la pratica della vaccinazione è ora standardizzata in tutto il mondo.
Gli effetti collaterali sono sempre stati segnalati, ma negli ultimi anni sembra che siano aumentati in numero e gravità, in particolare nei bambini come riporta l'Accademia americana di pediatria [1,2]. Ad esempio, il vaccino contro la difterite-tetano-pertosse (DTaP) era collegato a casi di sindrome della morte improvvisa del bambino (SIDS) [3]; vaccino contro morbillo-parotite-rosolia con autismo [4,5]; immunizzazioni multiple con disturbi immunitari [6]; vaccini contro l'epatite B con sclerosi multipla, ecc.
L'avviso di Tripedia DTaP di Sanofi Pasteur riporta che “Gli eventi avversi segnalati durante l'uso post-approvazione del vaccino Tripedia includono porpora trombocitopenica idiopatica, SIDS, reazione anafilattica, cellulite, autismo, convulsioni / convulsioni / grand mal convulsioni, encefalopatia, ipotonia, neuropatia, sonnolenza e apnea ”. Gli studi epidemiologici effettuati non hanno mostrato una chiara evidenza di tali associazioni, anche se nel 2011 la National Academy of Medicine (ex IOM) ha ammesso: "I vaccini non sono esenti da effetti collaterali o effetti avversi" [7].
Ricerche specifiche su componenti dei vaccini come adiuvanti (nella maggior parte dei casi, sali di alluminio) sono già indicate come possibili responsabili dei sintomi neurologici [8-10] e in alcuni casi, test in vivo e studi epidemiologici hanno dimostrato una possibile correlazione con malattie neurologiche [10,11]. I danni neurologici indotti in pazienti in emodialisi trattati con acqua contenente alluminio sono riportati in letteratura [12].
Recentemente, con i vaccini adottati in tutto il mondo contro il Papillomavirus umano (HPV), il dibattito è stato risvegliato a causa di alcuni effetti avversi segnalati da alcuni giovani soggetti.
Studi specifici hanno comunicato l'esistenza di sintomi correlati a sindromi mai descritte prima sviluppate dopo la somministrazione del vaccino. Ad esempio, Sindrome da dolore regionale complesso (CRPS), Sindrome da tachicardia posturale ortostatica (POTS) e Sindrome da affaticamento cronico (CFS) [13]. Gli effetti collaterali che possono insorgere in un tempo relativamente breve possono essere locali o sistemici.
Sono descritti dolore nel sito di iniezione, gonfiore e movimento incontrollabile delle mani (sebbene quest'ultimo sintomo possa anche essere considerato sistemico). Tra gli effetti sistemici, febbre, mal di testa, irritabilità, convulsioni epilettiche, perdita temporanea del linguaggio, disestesia e paresi degli arti inferiori, vampate di calore, disturbi del sonno, reazioni di ipersensibilità, dolore muscolare, sincope ricorrente, fame costante, significativa alterazione dell'andatura, incapacità di mantenere sono riportate la postura ortostatica [14].
È un dato di fatto che ogni giorno vengono somministrati milioni di dosi di vaccino e non accade nulla di rilevante, ma è anche irrefutabile che, indipendentemente dalla quantità di effetti collaterali che non sono stati registrati e la cui percentuale rimane in realtà sconosciuta, in un numero limitato di casi si verifica qualcosa di sbagliato. Non è stata data alcuna spiegazione soddisfacente o, in molti casi, nessuna spiegazione e sembra che tali effetti avversi si verifichino su base casuale e stocastica.
Tali situazioni ci hanno indotto a verificare la sicurezza dei vaccini da un punto di vista mai adottato prima: non un approccio biologico, ma fisico. Quindi, abbiamo sviluppato un nuovo metodo di analisi basato sull'uso di una indagine sul microscopio elettronico a scansione ambientale a pistola ad emissione di campo per rilevare possibili contaminazioni fisiche in tali prodotti.
I vaccini sono una delle invenzioni più importanti intese a proteggere le persone dalle malattie infettive. La pratica della varietà è vecchia di secoli ed è menzionata in documenti cinesi e indiani risalenti al 1000 d.C. Nel corso del tempo, la varietà è stata sostituita dalla vaccinazione, i vaccini sono stati migliorati in termini di tecnologia e la pratica della vaccinazione è ora standardizzata in tutto il mondo.
Gli effetti collaterali sono sempre stati segnalati, ma negli ultimi anni sembra che siano aumentati in numero e gravità, in particolare nei bambini come riporta l'Accademia americana di pediatria [1,2]. Ad esempio, il vaccino contro la difterite-tetano-pertosse (DTaP) era collegato a casi di sindrome della morte improvvisa del bambino (SIDS) [3]; vaccino contro morbillo-parotite-rosolia con autismo [4,5]; immunizzazioni multiple con disturbi immunitari [6]; vaccini contro l'epatite B con sclerosi multipla, ecc.
L'avviso di Tripedia DTaP di Sanofi Pasteur riporta che “Gli eventi avversi segnalati durante l'uso post-approvazione del vaccino Tripedia includono porpora trombocitopenica idiopatica, SIDS, reazione anafilattica, cellulite, autismo, convulsioni / convulsioni / grand mal convulsioni, encefalopatia, ipotonia, neuropatia, sonnolenza e apnea ”. Gli studi epidemiologici effettuati non hanno mostrato una chiara evidenza di tali associazioni, anche se nel 2011 la National Academy of Medicine (ex IOM) ha ammesso: "I vaccini non sono esenti da effetti collaterali o effetti avversi" [7].
Ricerche specifiche su componenti dei vaccini come adiuvanti (nella maggior parte dei casi, sali di alluminio) sono già indicate come possibili responsabili dei sintomi neurologici [8-10] e in alcuni casi, test in vivo e studi epidemiologici hanno dimostrato una possibile correlazione con malattie neurologiche [10,11]. I danni neurologici indotti in pazienti in emodialisi trattati con acqua contenente alluminio sono riportati in letteratura [12].
Recentemente, con i vaccini adottati in tutto il mondo contro il Papillomavirus umano (HPV), il dibattito è stato risvegliato a causa di alcuni effetti avversi segnalati da alcuni giovani soggetti.
Studi specifici hanno comunicato l'esistenza di sintomi correlati a sindromi mai descritte prima sviluppate dopo la somministrazione del vaccino. Ad esempio, Sindrome da dolore regionale complesso (CRPS), Sindrome da tachicardia posturale ortostatica (POTS) e Sindrome da affaticamento cronico (CFS) [13]. Gli effetti collaterali che possono insorgere in un tempo relativamente breve possono essere locali o sistemici.
Sono descritti dolore nel sito di iniezione, gonfiore e movimento incontrollabile delle mani (sebbene quest'ultimo sintomo possa anche essere considerato sistemico). Tra gli effetti sistemici, febbre, mal di testa, irritabilità, convulsioni epilettiche, perdita temporanea del linguaggio, disestesia e paresi degli arti inferiori, vampate di calore, disturbi del sonno, reazioni di ipersensibilità, dolore muscolare, sincope ricorrente, fame costante, significativa alterazione dell'andatura, incapacità di mantenere sono riportate la postura ortostatica [14].
È un dato di fatto che ogni giorno vengono somministrati milioni di dosi di vaccino e non accade nulla di rilevante, ma è anche irrefutabile che, indipendentemente dalla quantità di effetti collaterali che non sono stati registrati e la cui percentuale rimane in realtà sconosciuta, in un numero limitato di casi si verifica qualcosa di sbagliato. Non è stata data alcuna spiegazione soddisfacente o, in molti casi, nessuna spiegazione e sembra che tali effetti avversi si verifichino su base casuale e stocastica.
Tali situazioni ci hanno indotto a verificare la sicurezza dei vaccini da un punto di vista mai adottato prima: non un approccio biologico, ma fisico. Quindi, abbiamo sviluppato un nuovo metodo di analisi basato sull'uso di una indagine sul microscopio elettronico a scansione ambientale a pistola ad emissione di campo per rilevare possibili contaminazioni fisiche in tali prodotti.
Materiali e metodi
Sono stati analizzati 44 tipi di vaccini provenienti da 2 paesi (Italia e Francia). La tabella 1 li raggruppa in termini di nome, marchio e scopo.
N
Nome
Marchio, Paese di distribuzione
Descrizione
Lotto di produzione, data di scadenza
1
Vivotif Berna
Berna Biotech SA, Italia
Vaccino anti-tiroide (vivo), gruppo Ty21a
3000336 [2004]
2
Typhim Vi
Aventis Pasteur MSD, Italia
Vaccino anti-Salmonella typhi
U1510-2 [2004]
3
Typherix
GlaxoSmithKline Spa, Italia
Vaccino anti-ipoide (polisaccaride Vi)
ATYPB061BB [2009]
4
Anatetall
Chirone (ora Novartis) Italia
Vaccino antitetanico adsorbito
030106 [2004]
5
Anatetall
Vaccini e diagnostica Novartis, Italia
Vaccino antitetanico adsorbito
060510 [2009]
6
Tetabulin
Baxter AG, Italia
Vaccino antitetanico adsorbito
VNG2G006A [2009]
7
Dif-Tet-All
Vaccini e diagnostica Novartis, Italia
Vaccino adsorbito anti-tetano e difterite
070501 [2009]
8
Infanrix
GlaxoSmithKline Spa, Italia
Vaccino anti-difterite, tetano e pertosse
AC14B071AJ [2009]
9
Infanrix hexa
GlaxoSmithKline Biologicals s, Italia
Anti-difterite, tetano, pertosse, epatite B, poliomielite e malattia causata da Haemophilus influenzae di tipo b
A21CC512A [2017]
10
Infanrix hexa
GlaxoSmithKline Biologicals in Francia
Anti-difterite, tetano, pertosse, epatite B, poliomielite e malattia causata da Haemophilus influenzae di tipo b
A21CC421A [2017]
11
MMR vaxPro
Sanofi Pasteur MSD, Italia
MMR vaxPro (morbillo, parotite e rosolia) analizzato a Cambridge
L012437 [2017]
12
Repevax
Sanofi Pasteur MSD, Francia
Anti-difterite-tetano-pertosse-vaccino antipolio
L0362-1 [2017]
13
Repevax
Sanofi Pasteur MSD SNC France
Anti-difterite-tetano-pertosse-vaccino antipolio
L0033-1 [2016]
14
Priorix
GlaxoSmithKline Spa, Italia
Vaccino anti - morbillo-parotite e rosolia (MMR)
A69CB550A [2009]
15
Morupar
Chirone (ora Novartis,), Italia
Vaccino anti-morbillo-parotite e rosolia (MMR)
7601 [2004]
16
Varilrix
GlaxoSmithKline Spa, Italia
Vaccino contro la varicella (gruppo OKA)
A70CA567A [2009]
17
Stamaril Pasteur
Sanofi Pasteur MSD, Italia
vaccino contro la febbre gialla
A5329-6 [2009]
18
Allergoid-Adsorbat 6-Graser Starke B.
Allergopharma, Germania
Vaccino antiallergico
Ch-B.:30005999-B [2006]
19
Engerix-B
GlaxoSmithKline Spa, Italia
Vaccino adsorbito anti-epatite B.
AHBVB468BD [2009]
20
Prenevar 13
Pfizer, Italia
Vaccino anti-pneumococco
G79324 [2013]
21
Prevenar 13
Pfizer, Francia
Vaccino anti-pneumococco
N27430 [2018]
22
Mencevax Acwy
GlaxoSmithKline, Italia
Vaccino anti-Neisseria meningococcico gruppo A, C, W135 e Y.
N402A47B 12 [2004]
23
Meningitec
Pfizer, Italia
(gruppo C 10) (adsorbito su Al-fosfato)
H92709 [2015]
24
Meningitec
Pfizer-Italia
Vaccino anti-meningococco (gruppo C 10) (adsorbito su Al-fosfato)
H20500 [2014]
25
Meningitec
Pfizer-Italia
Vaccino anti-meningococco sequestrato da Procura della Repubblica
G76673 [2014]
26
Meningitec
Pfizer-Italia
Vaccino anti-meningococco sequestrato da Procura della Repubblica
H99459 [2015]
27
Meningitec
Pfizer-Italia
Vaccino anti-meningococco sequestrato da Procura della Repubblica
H52269 [2015]
28
Menjugate
Vaccini e diagnostica Novartis
Gruppo anti-meningococco C
YA0163AB [2010]
29
Menveo
Vaccini e diagnostica Novartis
Gruppi antimeningococcici A, C, W135, Y
A15083 [2017]
30
Meningitec
Wyeth Pharmaceutical - Francia
Vaccino anti-meningococco di gruppo C.
E83920 [2011]
31
Inflessale V
Berna Biotech
Vaccino antinfluenzale 2008/2009
3001463-01 [2009]
32
Vaxigrip
Sanofi Pasteur MSD
Vaccino antinfluenzale 2008/2009
D9703-1 [2009]
33
Vaxigrip
Sanofi Pasteur
Vaccino antinfluenzale 2012/2013
J8401-1 [2013]
34
Vaxigrip
Sanofi Pasteur, Italia
Vaccino antinfluenzale, con virus inattivato e diviso
M7319-1 [2016]
35
Focetria
Vaccini e diagnostica Novartis
Vaccino anti-pandemia H1N1
0902401 [2010]
36
AGRIPPAL
Novartis
Vaccino antinfluenzale 2012/2013
127002A [2013]
37
AGRIPPAL
Vaccini Novartis, Italia
Vaccino antinfluenzale con virus inattivato e diviso 2015/2016 -
152803 [2016]
38
Agrippal S1
Vaccini e diagnostica Novartis
Antigene inattivato / superficiale antinfluenzale v - 2014/2015
147302A [2015]
39
Fluarix
GlaxoSmithKline - GSK
Vaccino antinfluenzale 2013
AFLUA789AA [2014]
40
Fluad
Vaccini e diagnostica Novartis
Vaccino antigene inattivato / superficiale antinfluenzale - 2014/2015
142502 [2015]
41
Gardasil
Sanofi Pasteur MSD, Italia
Vaccino anti-HPV di tipo 6,11,16,18
NP01250 [2012]
42
Gardasil
Sanofi Pasteur MSD, Italia
Vaccino anti-HPV (tipi 6,11,16,18)
K023804 [2016]
43
Cervarix
GlaxoSmithKline Biological, Italia
Anti-HPV (tipo 16,18)
AHPVA238AX [2017]
44
Feligen CRP
Virbac SA - Carros - Italia
anti-panleucopenia, rinotracheite infettiva e infezioni da Calcivirus, vaccino veterinario per gatti
3R4R [2013]
Tabella 1: Elenco dei vaccini analizzati, in base al loro scopo.
Alcuni vaccini, in effetti una minoranza, hanno lo scopo di trattare un singolo batterio o virus, mentre altri sono multi-valenti. L'elenco dei vaccini che abbiamo analizzato può contenere nomi ripetuti, perché abbiamo considerato lotti diversi e anni di produzione dello stesso vaccino: quelli contro l'influenza in particolare.
Lo studio mirava a verificare una possibile contaminazione fisica. Per fare ciò, abbiamo eseguito un nuovo tipo di indagine basata su osservazioni nell'ambito di un microscopio a scansione di elettroni ambientali a cannone ad emissione di campo (FEG-ESEM, Quanta 200, FEI, Paesi Bassi) dotato della microprobe a raggi X di uno spettroscopio a dispersione di energia (EDS , EDAX, Mahwah, NJ, USA) per rilevare la possibile presenza di contaminanti inorganici, particolati e identificarne la composizione chimica.
Una siringa di circa 20 microlitri di vaccino viene rilasciata dalla siringa su un filtro in cellulosa di diametro 25 mm (Millipore, USA), all'interno di un armadio di flusso. Il filtro viene quindi depositato su un troncone di alluminio coperto da un disco di carbonio adesivo. Il campione viene immediatamente messo in una scatola pulita per evitare qualsiasi contaminazione e la scatola viene riaperta solo per il campione da inserire all'interno della camera FEG-ESEM. Abbiamo selezionato quel particolare tipo di microscopio in quanto consente di analizzare campioni acquosi e oleosi sotto vuoto (da 10 a 130 Pa) ad alta sensibilità.
Quando l'acqua e la soluzione salina contenute nel vaccino vengono evaporate, i componenti biologici / fisici emergono sul filtro ed è quindi possibile osservarli. Questo tipo di microscopio (osservazioni a basso vuoto) impedisce la possibile contaminazione del campione e la creazione di artefatti. Le osservazioni sono fatte con diversi sensori (SE: sensore di elettroni secondari e BSE: sensore di elettroni retrodiffusi) e vengono eseguite a una pressione di 8,9 e-1 mbar, a energie comprese tra 10 e 30kV per rilevare le dimensioni del particolato, morfologia e sua composizione elementare. Il metodo identifica corpi chiaramente inorganici con una densità atomica più elevata (dall'aspetto più bianco) rispetto al substrato biologico. Quindi, le entità organiche sono visibili e facili da distinguere da quelle inorganiche. Il metodo non è in grado di distinguere tra proteine e adiuvanti organici (ad es squalene, glutammato, proteine, ecc.) o virus, batteri, DNA dei batteri, endo-tossine e rifiuti dei batteri, ma la loro densità atomica relativamente bassa ci consente di identificare queste entità come materia organica. In alcuni vaccini, la sostanza organica contiene detriti dall'aspetto bianco chiamati aggregati, mentre un'alta concentrazione o detriti inorganici è chiamata cluster.
Vengono identificate, valutate e conteggiate singole particelle inorganiche o aggregati organico-inorganici. La procedura di conteggio viene ripetuta tre volte da tre diversi operatori, con un errore inferiore al 10%. Quando viene rilevato uno strato di sali (cloruro di sodio o alluminio), registriamo la situazione ma non facciamo il conteggio del corpo.
Sono stati analizzati 44 tipi di vaccini provenienti da 2 paesi (Italia e Francia). La tabella 1 li raggruppa in termini di nome, marchio e scopo.
N
|
Nome
|
Marchio, Paese di distribuzione
|
Descrizione
|
Lotto di produzione, data di scadenza
|
1
|
Vivotif Berna
|
Berna Biotech SA, Italia
|
Vaccino anti-tiroide (vivo), gruppo Ty21a
|
3000336 [2004]
|
2
|
Typhim Vi
|
Aventis Pasteur MSD, Italia
|
Vaccino anti-Salmonella typhi
|
U1510-2 [2004]
|
3
|
Typherix
|
GlaxoSmithKline Spa, Italia
|
Vaccino anti-ipoide (polisaccaride Vi)
|
ATYPB061BB [2009]
|
4
|
Anatetall
|
Chirone (ora Novartis) Italia
|
Vaccino antitetanico adsorbito
|
030106 [2004]
|
5
|
Anatetall
|
Vaccini e diagnostica Novartis, Italia
|
Vaccino antitetanico adsorbito
|
060510 [2009]
|
6
|
Tetabulin
|
Baxter AG, Italia
|
Vaccino antitetanico adsorbito
|
VNG2G006A [2009]
|
7
|
Dif-Tet-All
|
Vaccini e diagnostica Novartis, Italia
|
Vaccino adsorbito anti-tetano e difterite
|
070501 [2009]
|
8
|
Infanrix
|
GlaxoSmithKline Spa, Italia
|
Vaccino anti-difterite, tetano e pertosse
|
AC14B071AJ [2009]
|
9
|
Infanrix hexa
|
GlaxoSmithKline Biologicals s, Italia
|
Anti-difterite, tetano, pertosse, epatite B, poliomielite e malattia causata da Haemophilus influenzae di tipo b
|
A21CC512A [2017]
|
10
|
Infanrix hexa
|
GlaxoSmithKline Biologicals in Francia
|
Anti-difterite, tetano, pertosse, epatite B, poliomielite e malattia causata da Haemophilus influenzae di tipo b
|
A21CC421A [2017]
|
11
|
MMR vaxPro
|
Sanofi Pasteur MSD, Italia
|
MMR vaxPro (morbillo, parotite e rosolia) analizzato a Cambridge
|
L012437 [2017]
|
12
|
Repevax
|
Sanofi Pasteur MSD, Francia
|
Anti-difterite-tetano-pertosse-vaccino antipolio
|
L0362-1 [2017]
|
13
|
Repevax
|
Sanofi Pasteur MSD SNC France
|
Anti-difterite-tetano-pertosse-vaccino antipolio
|
L0033-1 [2016]
|
14
|
Priorix
|
GlaxoSmithKline Spa, Italia
|
Vaccino anti - morbillo-parotite e rosolia (MMR)
|
A69CB550A [2009]
|
15
|
Morupar
|
Chirone (ora Novartis,), Italia
|
Vaccino anti-morbillo-parotite e rosolia (MMR)
|
7601 [2004]
|
16
|
Varilrix
|
GlaxoSmithKline Spa, Italia
|
Vaccino contro la varicella (gruppo OKA)
|
A70CA567A [2009]
|
17
|
Stamaril Pasteur
|
Sanofi Pasteur MSD, Italia
|
vaccino contro la febbre gialla
|
A5329-6 [2009]
|
18
|
Allergoid-Adsorbat 6-Graser Starke B.
|
Allergopharma, Germania
|
Vaccino antiallergico
|
Ch-B.:30005999-B [2006]
|
19
|
Engerix-B
|
GlaxoSmithKline Spa, Italia
|
Vaccino adsorbito anti-epatite B.
|
AHBVB468BD [2009]
|
20
|
Prenevar 13
|
Pfizer, Italia
|
Vaccino anti-pneumococco
|
G79324 [2013]
|
21
|
Prevenar 13
|
Pfizer, Francia
|
Vaccino anti-pneumococco
|
N27430 [2018]
|
22
|
Mencevax Acwy
|
GlaxoSmithKline, Italia
|
Vaccino anti-Neisseria meningococcico gruppo A, C, W135 e Y.
|
N402A47B 12 [2004]
|
23
|
Meningitec
|
Pfizer, Italia
|
(gruppo C 10) (adsorbito su Al-fosfato)
|
H92709 [2015]
|
24
|
Meningitec
|
Pfizer-Italia
|
Vaccino anti-meningococco (gruppo C 10) (adsorbito su Al-fosfato)
|
H20500 [2014]
|
25
|
Meningitec
|
Pfizer-Italia
|
Vaccino anti-meningococco sequestrato da Procura della Repubblica
|
G76673 [2014]
|
26
|
Meningitec
|
Pfizer-Italia
|
Vaccino anti-meningococco sequestrato da Procura della Repubblica
|
H99459 [2015]
|
27
|
Meningitec
|
Pfizer-Italia
|
Vaccino anti-meningococco sequestrato da Procura della Repubblica
|
H52269 [2015]
|
28
|
Menjugate
|
Vaccini e diagnostica Novartis
|
Gruppo anti-meningococco C
|
YA0163AB [2010]
|
29
|
Menveo
|
Vaccini e diagnostica Novartis
|
Gruppi antimeningococcici A, C, W135, Y
|
A15083 [2017]
|
30
|
Meningitec
|
Wyeth Pharmaceutical - Francia
|
Vaccino anti-meningococco di gruppo C.
|
E83920 [2011]
|
31
|
Inflessale V
|
Berna Biotech
|
Vaccino antinfluenzale 2008/2009
|
3001463-01 [2009]
|
32
|
Vaxigrip
|
Sanofi Pasteur MSD
|
Vaccino antinfluenzale 2008/2009
|
D9703-1 [2009]
|
33
|
Vaxigrip
|
Sanofi Pasteur
|
Vaccino antinfluenzale 2012/2013
|
J8401-1 [2013]
|
34
|
Vaxigrip
|
Sanofi Pasteur, Italia
|
Vaccino antinfluenzale, con virus inattivato e diviso
|
M7319-1 [2016]
|
35
|
Focetria
|
Vaccini e diagnostica Novartis
|
Vaccino anti-pandemia H1N1
|
0902401 [2010]
|
36
|
AGRIPPAL
|
Novartis
|
Vaccino antinfluenzale 2012/2013
|
127002A [2013]
|
37
|
AGRIPPAL
|
Vaccini Novartis, Italia
|
Vaccino antinfluenzale con virus inattivato e diviso 2015/2016 -
|
152803 [2016]
|
38
|
Agrippal S1
|
Vaccini e diagnostica Novartis
|
Antigene inattivato / superficiale antinfluenzale v - 2014/2015
|
147302A [2015]
|
39
|
Fluarix
|
GlaxoSmithKline - GSK
|
Vaccino antinfluenzale 2013
|
AFLUA789AA [2014]
|
40
|
Fluad
|
Vaccini e diagnostica Novartis
|
Vaccino antigene inattivato / superficiale antinfluenzale - 2014/2015
|
142502 [2015]
|
41
|
Gardasil
|
Sanofi Pasteur MSD, Italia
|
Vaccino anti-HPV di tipo 6,11,16,18
|
NP01250 [2012]
|
42
|
Gardasil
|
Sanofi Pasteur MSD, Italia
|
Vaccino anti-HPV (tipi 6,11,16,18)
|
K023804 [2016]
|
43
|
Cervarix
|
GlaxoSmithKline Biological, Italia
|
Anti-HPV (tipo 16,18)
|
AHPVA238AX [2017]
|
44
|
Feligen CRP
|
Virbac SA - Carros - Italia
|
anti-panleucopenia, rinotracheite infettiva e infezioni da Calcivirus, vaccino veterinario per gatti
|
3R4R [2013]
|
Tabella 1: Elenco dei vaccini analizzati, in base al loro scopo.
Alcuni vaccini, in effetti una minoranza, hanno lo scopo di trattare un singolo batterio o virus, mentre altri sono multi-valenti. L'elenco dei vaccini che abbiamo analizzato può contenere nomi ripetuti, perché abbiamo considerato lotti diversi e anni di produzione dello stesso vaccino: quelli contro l'influenza in particolare.
Lo studio mirava a verificare una possibile contaminazione fisica. Per fare ciò, abbiamo eseguito un nuovo tipo di indagine basata su osservazioni nell'ambito di un microscopio a scansione di elettroni ambientali a cannone ad emissione di campo (FEG-ESEM, Quanta 200, FEI, Paesi Bassi) dotato della microprobe a raggi X di uno spettroscopio a dispersione di energia (EDS , EDAX, Mahwah, NJ, USA) per rilevare la possibile presenza di contaminanti inorganici, particolati e identificarne la composizione chimica.
Una siringa di circa 20 microlitri di vaccino viene rilasciata dalla siringa su un filtro in cellulosa di diametro 25 mm (Millipore, USA), all'interno di un armadio di flusso. Il filtro viene quindi depositato su un troncone di alluminio coperto da un disco di carbonio adesivo. Il campione viene immediatamente messo in una scatola pulita per evitare qualsiasi contaminazione e la scatola viene riaperta solo per il campione da inserire all'interno della camera FEG-ESEM. Abbiamo selezionato quel particolare tipo di microscopio in quanto consente di analizzare campioni acquosi e oleosi sotto vuoto (da 10 a 130 Pa) ad alta sensibilità.
Quando l'acqua e la soluzione salina contenute nel vaccino vengono evaporate, i componenti biologici / fisici emergono sul filtro ed è quindi possibile osservarli. Questo tipo di microscopio (osservazioni a basso vuoto) impedisce la possibile contaminazione del campione e la creazione di artefatti. Le osservazioni sono fatte con diversi sensori (SE: sensore di elettroni secondari e BSE: sensore di elettroni retrodiffusi) e vengono eseguite a una pressione di 8,9 e-1 mbar, a energie comprese tra 10 e 30kV per rilevare le dimensioni del particolato, morfologia e sua composizione elementare. Il metodo identifica corpi chiaramente inorganici con una densità atomica più elevata (dall'aspetto più bianco) rispetto al substrato biologico. Quindi, le entità organiche sono visibili e facili da distinguere da quelle inorganiche. Il metodo non è in grado di distinguere tra proteine e adiuvanti organici (ad es squalene, glutammato, proteine, ecc.) o virus, batteri, DNA dei batteri, endo-tossine e rifiuti dei batteri, ma la loro densità atomica relativamente bassa ci consente di identificare queste entità come materia organica. In alcuni vaccini, la sostanza organica contiene detriti dall'aspetto bianco chiamati aggregati, mentre un'alta concentrazione o detriti inorganici è chiamata cluster.
Vengono identificate, valutate e conteggiate singole particelle inorganiche o aggregati organico-inorganici. La procedura di conteggio viene ripetuta tre volte da tre diversi operatori, con un errore inferiore al 10%. Quando viene rilevato uno strato di sali (cloruro di sodio o alluminio), registriamo la situazione ma non facciamo il conteggio del corpo.
risultati
Le indagini hanno verificato la composizione fisico-chimica dei vaccini considerati in base al componente inorganico dichiarato dal produttore. Nel dettaglio, abbiamo verificato la presenza di sali salini e di alluminio, ma è stata identificata in ogni caso un'ulteriore presenza di corpi estranei microorganici, submicroscopici e nanosized (inorganici, che vanno da 100 nm a circa dieci micron), la cui presenza non era dichiarato negli opuscoli consegnati nella confezione del prodotto (Tabella 2).
N
Azienda
Nome
alluminio
Elementi identificati
1
Allergopharma - Germania
allergoidi
sì
Al
2
Aventis Pasteur MSD Lyon - Francie
Typhim Vi
no
BrKP, PbSi, FeCr, PbClSiTi
3
Baxter AG
Tetabulin
no
SiMg, Fe, SiTiAl, SBa, Zn
4
Berna Biotech
Vivotif Berna
no
FeAl, ZrAlHf, SrAl, BiAlCl
5
Berna Biotech
Inflessale V
no
CuSnPbZn, Fe, CaSiAl, SiAl, NaPZn, ZnP, AlSiTi
6
Chiron
Anatetall
Al (OH) 3
FeAl, SZnBaAl
7
Chiron
Morupar
no
/
8
GlaxoSmithKline- Belgio
Mencevax ACWY
no
FeCrNi, ZrAl, FeCrNiZrAlSi
9
GlaxoSmithKline
Infanrix
Al (OH) 3
Al, AlTi, AlSi
10
GlaxoSmithKline Biologicals
Infanrix hexa
Al (OH) 3
SBa, FeCu, SiAl, FeSi, CaMgSi, AlCaSi, Ti, Au, SCa, SiAlFeSnCuCrZn, CaAlSi
11
GlaxoSmithKline Biologicals
Infanrix hexa
Al (OH) 3 , AlPO 4. 2H 2 O
W, FeCrNi, Ti
12
GlaxoSmithKline
Typherix
no
Ti, TiW, AlSiTiWCr, SBa, W, SiAl, AlSiTi
13
GlaxoSmithKline
Priorix
no
WCa, WFeCu, SiAl, SiMg, PbFe, Ti, WNiFe
14
GlaxoSmithKline
Engerix-B
no
Al (precipitati)
15
GlaxoSmithKline
Varilrix
no
FeZn, FeSi, AlSiFe, SiAlTiFe, MgSi, Ti, Zr, Bi
16
GlaxoSmithKline
Fluarix
no
AlCu, Fe, AlBi, Si, SiZn, AlCuFe, SiMg, SBa, AlCuBi, FeCrNi, SPZn
17
GlaxoSmithKline Biologicals
Cervarix
Al (OH) 3
AlSi, FeAl, SiMg, CaSiAl, CaZn, FeAlSi, FeCr, CuSnPb
18
Vaccini e diagnostica Novartis
Anatetall
Al (OH) 3
Al, FeCrNi, AlCr, AlFe, BaS, ZnAl
19
Vaccini e diagnostica Novartis
Dif-Tet-All
Al (OH) 3
Fe, SBa, SiSBa, AlZnCu, AlZnFeCr
20
Vaccini e diagnostica Novartis
Kit menugato
Al (OH) 3
SiAl, Ti, FeZn, Fe, Sb, SiAlFeTi, W, Zr
21
Vaccini e diagnostica Novartis
Focetria
no
Fe, FeCrNiCu, FeCrNi, SiFeCrNi, Cr, SiAlFe, AlSiTiFe, AlSi, SiMgFe, Si, FeZn
22
Novartis
Agrippal S1
no
Ca, Fe, SBa, SBaZn, Cr, Si, Pb, Bi, e FeSiAlCr, SiAlSBaFe, CaAlSi, Zn, CeFeTiNi, FeCrNi
23
Vaccini e diagnostica Novartis
Agrippal S1
no
SiAlK, Si, SiMgFe, CaSiAl, SBaZn
24
Vaccini Novartis
AGRIPPAL
no
Cr, Ca, SiCaAl, ZrSi, SBa, CuZn, SCa
25
Vaccini e diagnostica Novartis S
Fluad
no
CaSiAl, FeSiTi, SiMgAlFe, SBa
26
Vaccini e diagnostica Novartis
Menveo
no
CaSiAl, SiAlFe, FeCrNi, Fe, Al, SBa
27
Pfizer
Prenevar 13
no
FeCr
28
Pfizer
Prevenar 13
no
W, CaAlSi, Al, CaSiAlFe, FeS, FeCr, FeCrNi, Fe,, CaP, FeTiMn, Ba, SiMgAlFe
29
Pfizer
Meningitec - ctrl
no
Cr, Si
30
Pfizer
Meningitec - ctrl
no
FeCrNi, W
31
Pfizer
Meningitec
no
CaSiAl, CaSi, SiAlFeTi, FeCrNi, W, Fe, Pb
32
Pfizer
Meningitec
no
Cr (precipitati), Ca, AlSi
33
Pfizer
Meningitec
no
W, SiCa, CaSi, Pb, FeCrNi, Cr
34
Wyeth Pharmaceutical - Regno Unito
Meningitec
no
SiAlFe, SiAlTi, SiMgFe, W, Fe, Zr, Pb, Ca, Zn, FeCrNi
35
Sanofi Pasteur MSD-France
Vaxigrip
no
Fe, FeCrNi, SiAlFe, AlSi, SiAlFeCr
36
Sanofi Pasteur MSD
Stamaril Pasteur
no
CaSiAl, AlSi, Fe, SiMgFe, SiMgAlFe, CrSiFeCr, CrSiCuFe
37
Sanofi Pasteur MSD
Gardasil
AlPO 4 . 2H 2 O
AlCuFe, PbBi, Pb, Bi, Fe
38
Sanifi Pasteur MSD
Gardasil
AlPO 4 . 2H 2 O
CaAlSi, AlSi, SiMgFe, Al, Fe, AlCuFe, FeSiAl, BiBaS, Ti, TiAlSi
39
Sanofi Pasteur
Vaxigrip
no
Ca, CrFe, FeCrNi, CaSZn, CaSiAlTiFe, Ag, Fe
40
Sanofi Pasteur
Vaxigrip
no
SiMgFe, CaSiAl, AlSiFe, AlSi, FeCr, FeZn, Fe
41
Sanofi Pasteur MSD
Repevax
AlPO 4 .2H 2 O
Bi, Fe, AlSiFe, SiMg, SBa, Ca
42
Sanofi Pasteur MSD S
Repevax
AlPO 4 .2H 2 O
Ti, Br, AuCuZn, Ca, SiZn, SiAuAgCu, SiMgFe, FeCrNi.AlSiMgTiMnCrFe, SiFeCrNi, FeAl
43
Sanofi Pasteur MSD
MMR vaxPro
no
Si, SiFeCrNi, FeCrNi, FeNi, Fe, SCa, AlSiCa, CaAlSiFeV, SBa, Pt, PtAgBiFeCr
44
Virbac SA - Carros - Francia
Feligen CRP
no
Ca, SiAl
Tabella 2: Elenco dei vaccini secondo i loro produttori con la composizione chimica dei detriti identificati in ciascun campione. Vengono riportati gli elementi più rappresentati.
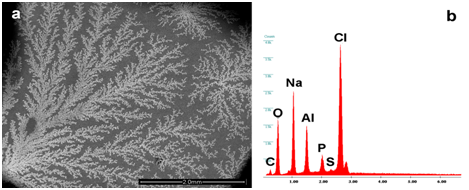
La Figura 1a mostra uno strato di cristalli di cloruro di sodio (NaCl) che incorporano sali di fosfato di alluminio (AlPO
Le indagini hanno verificato la composizione fisico-chimica dei vaccini considerati in base al componente inorganico dichiarato dal produttore. Nel dettaglio, abbiamo verificato la presenza di sali salini e di alluminio, ma è stata identificata in ogni caso un'ulteriore presenza di corpi estranei microorganici, submicroscopici e nanosized (inorganici, che vanno da 100 nm a circa dieci micron), la cui presenza non era dichiarato negli opuscoli consegnati nella confezione del prodotto (Tabella 2).
N
|
Azienda
|
Nome
|
alluminio
|
Elementi identificati
|
1
|
Allergopharma - Germania
|
allergoidi
|
sì
|
Al
|
2
|
Aventis Pasteur MSD Lyon - Francie
|
Typhim Vi
|
no
|
BrKP, PbSi, FeCr, PbClSiTi
|
3
|
Baxter AG
|
Tetabulin
|
no
|
SiMg, Fe, SiTiAl, SBa, Zn
|
4
|
Berna Biotech
|
Vivotif Berna
|
no
|
FeAl, ZrAlHf, SrAl, BiAlCl
|
5
|
Berna Biotech
|
Inflessale V
|
no
|
CuSnPbZn, Fe, CaSiAl, SiAl, NaPZn, ZnP, AlSiTi
|
6
|
Chiron
|
Anatetall
|
Al (OH) 3
|
FeAl, SZnBaAl
|
7
|
Chiron
|
Morupar
|
no
|
/
|
8
|
GlaxoSmithKline- Belgio
|
Mencevax ACWY
|
no
|
FeCrNi, ZrAl, FeCrNiZrAlSi
|
9
|
GlaxoSmithKline
|
Infanrix
|
Al (OH) 3
|
Al, AlTi, AlSi
|
10
|
GlaxoSmithKline Biologicals
|
Infanrix hexa
|
Al (OH) 3
|
SBa, FeCu, SiAl, FeSi, CaMgSi, AlCaSi, Ti, Au, SCa, SiAlFeSnCuCrZn, CaAlSi
|
11
|
GlaxoSmithKline Biologicals
|
Infanrix hexa
|
Al (OH) 3 , AlPO 4. 2H 2 O
|
W, FeCrNi, Ti
|
12
|
GlaxoSmithKline
|
Typherix
|
no
|
Ti, TiW, AlSiTiWCr, SBa, W, SiAl, AlSiTi
|
13
|
GlaxoSmithKline
|
Priorix
|
no
|
WCa, WFeCu, SiAl, SiMg, PbFe, Ti, WNiFe
|
14
|
GlaxoSmithKline
|
Engerix-B
|
no
|
Al (precipitati)
|
15
|
GlaxoSmithKline
|
Varilrix
|
no
|
FeZn, FeSi, AlSiFe, SiAlTiFe, MgSi, Ti, Zr, Bi
|
16
|
GlaxoSmithKline
|
Fluarix
|
no
|
AlCu, Fe, AlBi, Si, SiZn, AlCuFe, SiMg, SBa, AlCuBi, FeCrNi, SPZn
|
17
|
GlaxoSmithKline Biologicals
|
Cervarix
|
Al (OH) 3
|
AlSi, FeAl, SiMg, CaSiAl, CaZn, FeAlSi, FeCr, CuSnPb
|
18
|
Vaccini e diagnostica Novartis
|
Anatetall
|
Al (OH) 3
|
Al, FeCrNi, AlCr, AlFe, BaS, ZnAl
|
19
|
Vaccini e diagnostica Novartis
|
Dif-Tet-All
|
Al (OH) 3
|
Fe, SBa, SiSBa, AlZnCu, AlZnFeCr
|
20
|
Vaccini e diagnostica Novartis
|
Kit menugato
|
Al (OH) 3
|
SiAl, Ti, FeZn, Fe, Sb, SiAlFeTi, W, Zr
|
21
|
Vaccini e diagnostica Novartis
|
Focetria
|
no
|
Fe, FeCrNiCu, FeCrNi, SiFeCrNi, Cr, SiAlFe, AlSiTiFe, AlSi, SiMgFe, Si, FeZn
|
22
|
Novartis
|
Agrippal S1
|
no
|
Ca, Fe, SBa, SBaZn, Cr, Si, Pb, Bi, e FeSiAlCr, SiAlSBaFe, CaAlSi, Zn, CeFeTiNi, FeCrNi
|
23
|
Vaccini e diagnostica Novartis
|
Agrippal S1
|
no
|
SiAlK, Si, SiMgFe, CaSiAl, SBaZn
|
24
|
Vaccini Novartis
|
AGRIPPAL
|
no
|
Cr, Ca, SiCaAl, ZrSi, SBa, CuZn, SCa
|
25
|
Vaccini e diagnostica Novartis S
|
Fluad
|
no
|
CaSiAl, FeSiTi, SiMgAlFe, SBa
|
26
|
Vaccini e diagnostica Novartis
|
Menveo
|
no
|
CaSiAl, SiAlFe, FeCrNi, Fe, Al, SBa
|
27
|
Pfizer
|
Prenevar 13
|
no
|
FeCr
|
28
|
Pfizer
|
Prevenar 13
|
no
|
W, CaAlSi, Al, CaSiAlFe, FeS, FeCr, FeCrNi, Fe,, CaP, FeTiMn, Ba, SiMgAlFe
|
29
|
Pfizer
|
Meningitec - ctrl
|
no
|
Cr, Si
|
30
|
Pfizer
|
Meningitec - ctrl
|
no
|
FeCrNi, W
|
31
|
Pfizer
|
Meningitec
|
no
|
CaSiAl, CaSi, SiAlFeTi, FeCrNi, W, Fe, Pb
|
32
|
Pfizer
|
Meningitec
|
no
|
Cr (precipitati), Ca, AlSi
|
33
|
Pfizer
|
Meningitec
|
no
|
W, SiCa, CaSi, Pb, FeCrNi, Cr
|
34
|
Wyeth Pharmaceutical - Regno Unito
|
Meningitec
|
no
|
SiAlFe, SiAlTi, SiMgFe, W, Fe, Zr, Pb, Ca, Zn, FeCrNi
|
35
|
Sanofi Pasteur MSD-France
|
Vaxigrip
|
no
|
Fe, FeCrNi, SiAlFe, AlSi, SiAlFeCr
|
36
|
Sanofi Pasteur MSD
|
Stamaril Pasteur
|
no
|
CaSiAl, AlSi, Fe, SiMgFe, SiMgAlFe, CrSiFeCr, CrSiCuFe
|
37
|
Sanofi Pasteur MSD
|
Gardasil
|
AlPO 4 . 2H 2 O
|
AlCuFe, PbBi, Pb, Bi, Fe
|
38
|
Sanifi Pasteur MSD
|
Gardasil
|
AlPO 4 . 2H 2 O
|
CaAlSi, AlSi, SiMgFe, Al, Fe, AlCuFe, FeSiAl, BiBaS, Ti, TiAlSi
|
39
|
Sanofi Pasteur
|
Vaxigrip
|
no
|
Ca, CrFe, FeCrNi, CaSZn, CaSiAlTiFe, Ag, Fe
|
40
|
Sanofi Pasteur
|
Vaxigrip
|
no
|
SiMgFe, CaSiAl, AlSiFe, AlSi, FeCr, FeZn, Fe
|
41
|
Sanofi Pasteur MSD
|
Repevax
|
AlPO 4 .2H 2 O
|
Bi, Fe, AlSiFe, SiMg, SBa, Ca
|
42
|
Sanofi Pasteur MSD S
|
Repevax
|
AlPO 4 .2H 2 O
|
Ti, Br, AuCuZn, Ca, SiZn, SiAuAgCu, SiMgFe, FeCrNi.AlSiMgTiMnCrFe, SiFeCrNi, FeAl
|
43
|
Sanofi Pasteur MSD
|
MMR vaxPro
|
no
|
Si, SiFeCrNi, FeCrNi, FeNi, Fe, SCa, AlSiCa, CaAlSiFeV, SBa, Pt, PtAgBiFeCr
|
44
|
Virbac SA - Carros - Francia
|
Feligen CRP
|
no
|
Ca, SiAl
|
Tabella 2: Elenco dei vaccini secondo i loro produttori con la composizione chimica dei detriti identificati in ciascun campione. Vengono riportati gli elementi più rappresentati.
Guardando l'area al di fuori di questi precipitati ma all'interno della goccia di liquido, abbiamo identificato altre cose: singole particelle, gruppi di particelle e aggregati (composti organici-inorganici) che sono dovuti a un'interazione del particolato inorganico con la parte organica del vaccino .
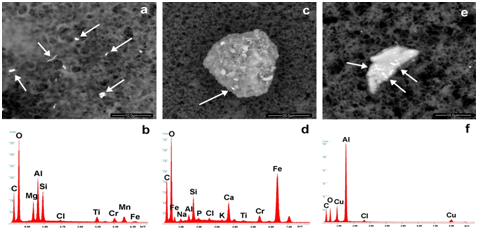
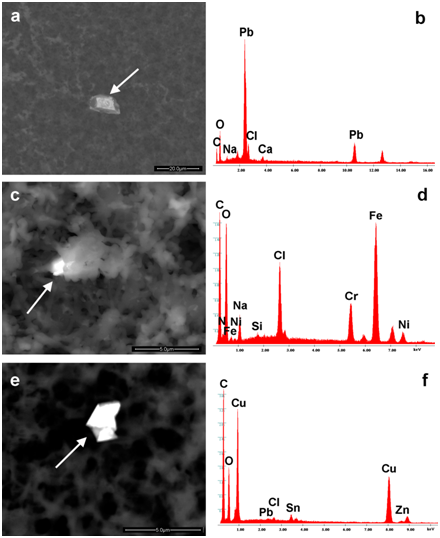
La Figura 2a-2f mostra la diversa tipologia di entità identificate nei vaccini (Repevax, Prevenar e Gardasil); particelle singole, cluster di micro e nanoparticelle (<100 nm) e aggregati con i loro spettri EDS (Figura 2d-2f). Le immagini (Figura 2a e 2d) mostrano detriti di Alluminio, Silicio, Magnesio e Titanio; di particelle di ferro, cromo, silicio e calcio (Figura 2b e 2e) disposte in un cluster e detriti di alluminio e rame (Figura 2c & 2f) in un aggregato.
Figura 2: Immagini di singole particelle, cluster di micro e nanoparticelle (<100 nm) e aggregati con i loro spettri EDS. Sono rispettivamente composti da (a, b) alluminio, silicio, magnesio, titanio, cromo, manganese, ferro, (c, d) ferro, silicio, titanio di calcio, cromo, (e, f) alluminio, rame. Le frecce mostrano i punti in cui sono stati rilevati gli spettri EDS.
Come si può vedere, le particelle sono circondate e incorporate in un substrato biologico. In tutti i campioni analizzati, abbiamo identificato particelle contenenti: Piombo (Typhym, Cervarix, Agrippal S1, Meningitec, Gardasil) o acciaio inossidabile (Mencevax, Infarix Hexa, Cervarix. Anatetall, Focetria, Agrippal S1, Menveo, Prevenar 13, Meningitec, Vaxigrip , Stamaril Pasteur, Repevax e MMRvaxPro).
La Figura 3a-3d mostra particelle di tungsteno identificate in gocce di Prevenar e Infarix (alluminio, tungsteno, cloruro di calcio).
Figura 3: Immagini di particelle di tungsteno identificate in gocce di Prevenar e Infarix. Sono composti rispettivamente da tungsteno, alluminio, ferro ma in diverse concentrazioni. Le frecce mostrano i punti in cui sono stati rilevati gli spettri EDS.
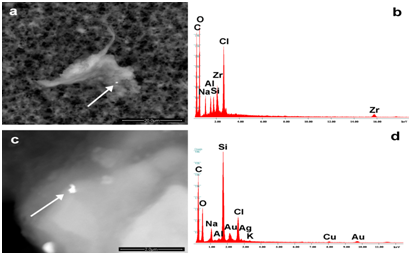
La Figura 4a-4d presenta detriti singolari trovati in Repevax (silicio, oro, argento) e Gardasil (zirconio).
Figura 4: Le immagini mostrano esempi di nano biointerazione. L'aggregato (a, b) identificato in Gardasil contiene nanoparticelle di cloro, silicio, alluminio, zirconio, mentre i detriti trovati in Repevax contengono silicio, oro, argento (c, d). Le frecce mostrano i punti in cui sono stati rilevati gli spettri EDS.
Sono state inoltre identificate alcune particelle metalliche di tungsteno o acciaio inossidabile. Altre particelle contenenti zirconio, afnio, stronzio e alluminio (Vivotif, Meningetec); Tungsteno, Nichel, Ferro (Priorix, Meningetec); Antimonio (kit di Menjugate); Cromo (meningetec); Sono stati trovati anche oro o oro, zinco (Infarix Hexa, Repevax) o platino, argento, bismuto, ferro, cromo (MMRvaxPro) o piombo, bismuto (Gardasil) o cerio (Agrippal S1). L'unico tungsteno appare nei vaccini 8/44, mentre il cromo (da solo o in lega con ferro e nichel) nel 25/44. Le indagini hanno rivelato che alcune particelle sono incorporate in un substrato biologico, probabilmente proteine, endo-tossine e residui di batteri. Non appena una particella viene a contatto con fluidi proteici, si verifica una nano-biointerazione [6] e si forma una "corona proteica" [7-10].
La Figura 5a-5f mostra esempi di queste nano-bio-interazioni. Si possono vedere aggregati (entità composite stabili) contenenti particelle di piombo in Meningitec, (Figura 5a e 5b) di acciaio inossidabile (ferro, cromo e nichel, figura 5c e 5d) e di rame, zinco e piombo in Cervarix (Figura 5e & 5f). Aggregati simili, sebbene in diverse situazioni (pazienti che soffrono di leucemia o crioglobulinemia), sono già stati descritti in letteratura.
Figura 5: mostra particelle circondate da un composto organico. Sono composti da piombo (a, b), ferro, cromo, nichel (acciaio inossidabile; c, d), rame, stagno, piombo (e, f). Le frecce mostrano i punti in cui sono stati rilevati gli spettri EDS.
Il legame tra queste due entità genera uno sviluppo delle proteine che può indurre un effetto autoimmune una volta che tali proteine vengono iniettate nell'uomo.
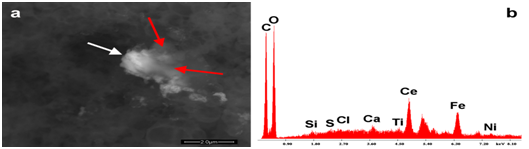
Le figure 6a e 6b mostrano uno dei corpi estranei identificati in Agrippal. La particella è composta da cerio, ferro, titanio e nichel. (Figure 7a e 7b) presentano un'area di Repevax in cui la morfologia dei globuli rossi - non possiamo dire se sono umani o animali - è chiaramente visibile.
Figura 6: mostra un aggregato organico contenente detriti di cerio, ferro, nichel, titanio. La freccia rossa indica lo strato organico (meno atomicamente denso) che copre la particella di cerio.
Figura 7: Immagine di un'area in una goccia di Repevax in cui è stata identificata la morfologia dei globuli rossi (frecce rosse). È impossibile sapere se sono di origine umana o animale. Tra i detriti di soluzione salina e fosfato di alluminio, vi è la presenza di detriti (frecce bianche) composti da alluminio, bromo, silicio, potassio, titanio.
La tabella 3 riassume il numero e la morfologia dei detriti identificati, in termini di singole particelle, gruppi di particelle o aggregati (composti organico-inorganici), mentre la Figura 8 mostra il grafico ottenuto calcolando il numero totale di particelle (particelle più cluster più aggregati) identificato per 20 microl di ogni vaccino.
Nome
|
Detriti totali n.
|
Gamma di dimensioni in m m
|
Cluster n.
|
Gamma di dimensioni in mm
|
Aggregato n. (Gamma di particelle)
|
Gamma di dimensioni m m
|
allergoidi
|
Precipitati di NaCl
|
/
|
/
|
/
|
/
|
/
|
Typhim Vi
|
394
|
0,1-2,5
|
3 [9-350]
|
2-35
| ||
Tetabulin
|
519
|
0,1-15
|
3 [100-180]
|
25-60
| ||
Vivotif Berna
|
4
|
1,5-15
| ||||
Inflessale V
|
103
|
0,1-17
|
1
|
20
|
3 [35-45]
|
10-25
|
Anatetall
|
2
|
1-3
| ||||
Morupar
|
/
|
/
|
/
| |||
Mencevax ACWY
|
13
|
0,2-5
| ||||
Infanrix
|
3
|
1-5
|
1
|
25
| ||
Infanrix hexa
|
1821
|
0,1-15
|
15 [1820]
|
20-140
| ||
Infanrix hexa
|
162
|
0,3-7
|
12
|
60
|
2 [7 detriti]
|
3,5-44
|
Typherix
|
8
|
0,2-8
|
1
|
15
| ||
Priorix
|
641
|
0,05-30
|
1
|
10
|
3 [600]
|
20-70
|
Engerix-B
|
precipitati
|
/
| ||||
Varilrix
|
2723
|
0,1-4
|
36 [120-2000]
|
15-40
| ||
Fluarix
|
1317
|
0,1-40
|
3 [83]
|
7-30
| ||
Cervarix
|
1569
|
0,2-3
|
2
|
5-10
|
4 [1400]
|
8-30
|
Anatetall
|
47
|
0,05-40
| ||||
Dif-Tet-All
|
111
|
0,2-3
| ||||
Menjugate
|
73
|
0,1-5
| ||||
Focetria
|
35
|
0,7-10
| ||||
Agrippal S1
|
430
|
0,2-6
|
13
|
0,2-80
|
5 [410]
|
20
|
Agrippal S1
|
1029
|
0,1-12
|
9 [1025]
|
35-80
| ||
AGRIPPAL
|
480
|
0,1-6
|
11 [460]
|
2-80
| ||
Fluad
|
605
|
0,2-15
|
4
|
12-25
|
6 [600]
|
70
|
Menveo
|
452
|
0,1-13
|
4 [430]
|
30-110
| ||
Prenevar 13
|
precipita + 5 detriti
|
1-7
| ||||
Prevenar 13
|
precipita + 81 detriti
|
0,2-50
|
3
|
5-40
|
1 [60]
|
25
|
Meningitec
|
3
|
10-20
| ||||
Meningitec
|
24
|
8-60
| ||||
Meningitec
|
673
|
0,1-20
|
1
|
7
|
9 [624]
|
5-110
|
Meningitec
|
precipitati + 40
|
0,1-3,5
|
2 [40]
|
25-70
| ||
Meningitec
|
177
|
0,2-10
|
3 [165]
|
15-100
| ||
Meningitec
|
241
|
0,1-15
|
1
|
50
|
2 [230]
|
50
|
Vaxigrip
|
86
|
0,1-7
|
2 [50]
|
2-2,5
| ||
Stamaril Pasteur
|
152
|
0,1-7
|
2
|
5-7
|
3 [145]
|
4-20
|
Gardasil
|
304
|
0,05-3
|
1 [300]
|
15
| ||
Gardasil
|
454
|
0,1-30
|
2
|
7-20
|
9 [445]
|
5-60
|
Vaxigrip
|
304
|
0,1-10
|
1
|
13
|
2 [300]
|
35
|
Vaxigrip
|
674
|
0,3-25
|
2
|
2-12
|
10 [660]
|
9-150
|
Repevax
|
137
|
0,1-20
|
2 [130]
|
40-50
| ||
Repevax
|
214
|
0,1-10
|
6 [150]
|
5-30
| ||
MMR vaxPro
|
93
|
0,1-15
|
2 [50]
|
Ott-15
| ||
Feligen CRP
|
92
|
0,1-12
|
1
|
12
|
1 (40 detriti)
|
25
|
Tabella 3: Elenco del numero di detriti identificato in ciascun vaccino come singola particella, cluster e aggregati. La caratterizzazione è fatta da forma, intervallo di dimensioni e variabilità del numero di particelle contate in ciascun aggregato [tra parentesi].
Figura 8: Grafico delle quantità di detriti identificate in una goccia da 20 microl di ciascun vaccino.
Aggregati simili sono già stati descritti da altri scienziati che li hanno identificati nel sangue, ad esempio nei pazienti leucemici [15] e in soggetti affetti da crioglobulinemia [16].
Non tutti i vaccini analizzati contengono la stessa contaminazione, anche se lo stesso vaccino appartenente a lotti diversi e, in alcuni casi, proveniente da paesi diversi può contenere una contaminazione simile (ad esempio i vaccini di Glaxo Infarix, Typherix e Priorix contengono tungsteno. identificato nel kit Menjugate di Novartis e Prevenar, Meningitec di Pfizer e Meningitec di Wyeth).]
Feligen, l'unico vaccino veterinario testato, si è rivelato l'unico campione privo di contaminazione inorganica, mentre l'allergoide genera uno strato di sali inorganici così denso da non consentire di rilevare altri contaminanti da particolato.
Discussione
La quantità di corpi estranei rilevati e, in alcuni casi, le loro insolite composizioni chimiche ci hanno sconcertato. Le particelle inorganiche identificate non sono né biocompatibili né biodegradabili, ciò significa che sono biopersistenti e possono indurre effetti che possono diventare evidenti o immediatamente vicini al tempo di iniezione o dopo un certo tempo dalla somministrazione. È importante ricordare che le particelle (cristalli e non molecole) sono corpi estranei all'organismo e si comportano come tali. Più in particolare, la loro tossicità è per alcuni aspetti diversa da quella degli elementi chimici che li compongono, aggiungendo a quella tossicità che, in ogni caso, è ancora presente, quella tipica di corpi estranei. Per tale motivo, inducono una reazione infiammatoria.
Dopo l'iniezione, tali microparticelle, nanoparticelle e aggregati possono rimanere attorno al sito di iniezione formando gonfiori e granulomi [17]. Ma possono anche essere trasportati dalla circolazione sanguigna, sfuggendo a qualsiasi tentativo di indovinare quale sarà la loro destinazione finale. Riteniamo che in molti casi si distribuiscano in tutto il corpo senza causare alcuna reazione visibile, ma è anche probabile che, in alcune circostanze, raggiungano un certo organo, nessuno escluso, incluso il microbiota, in discrete quantità. Come accade con tutti i corpi estranei, in particolare quelli piccoli, inducono una reazione infiammatoria cronica perché la maggior parte di quelle particelle non può essere degradata. Inoltre, l'effetto proteina-corona (dovuto a una nano-bio-interazione [18]) può produrre particelle composite organiche / inorganiche in grado di stimolare il sistema immunitario in modo indesiderato [19-22]. È impossibile non aggiungere che particelle delle dimensioni spesso osservate nei vaccini possono entrare nei nuclei cellulari e interagire con il DNA [23].
In alcuni casi, ad esempio come accade con il ferro e alcune leghe di ferro, possono corrodersi e i prodotti di corrosione esercitano una tossicità per i tessuti [24-26].
Il rilevamento della presenza di sali di alluminio e NaCl è ovvio in quanto sono sostanze utilizzate dai produttori e dichiarate come componenti, ma non si suppone che altri materiali siano presenti nel vaccino o in qualsiasi altro farmaco iniettabile, e, in ogni caso , L'alluminio è già stato associato a malattie neurologiche [27-29].
Date le contaminazioni che abbiamo osservato in tutti i campioni di vaccini per uso umano, gli effetti negativi dopo l'iniezione di tali vaccini sono possibili e credibili e hanno il carattere di casualità, poiché dipendono da dove i contaminanti sono trasportati dalla circolazione sanguigna. È ovvio che quantità simili di questi corpi estranei possono avere un impatto più grave su organismi molto piccoli come quelli dei bambini. La loro presenza nei muscoli, a causa di uno stravaso dal sangue, potrebbe compromettere pesantemente la funzionalità muscolare [30,31].
Incontriamo particelle con composizioni chimiche, simili a quelle trovate nei vaccini che abbiamo analizzato, quando studiamo casi di contaminazione ambientale causati da diverse fonti di inquinamento. Nella maggior parte dei casi, le combinazioni rilevate sono molto strane in quanto non hanno un uso tecnico, non possono essere trovate in nessun manuale del materiale e sembrano il risultato della formazione casuale che si verifica, ad esempio, quando i rifiuti vengono bruciati. In ogni caso, qualunque sia la loro origine, non dovrebbero essere presenti in alcun medicinale iniettabile, figuriamoci nei vaccini, più in particolare quelli destinati ai bambini.
Altre forme di contaminazioni finora sconosciute sono state recentemente osservate e, in ogni caso, i vaccini contengono componenti che potrebbero a loro volta essere la causa di effetti avversi. È un fatto ben noto in tossicologia che i contaminanti esercitano un effetto reciproco e sinergico e quando il numero di contaminanti aumenta, gli effetti diventano sempre meno prevedibili. Tanto più quando alcune sostanze sono sconosciute.
È un dato di fatto, non esistono dati ufficiali esaustivi e affidabili sugli effetti collaterali indotti dai vaccini. Le prove episodiche riportate da persone presumibilmente danneggiate dai vaccini sono duplici: alcuni sostengono che il danno si sia verificato e sia diventato visibile entro poche ore dalla somministrazione, e alcuni sostengono che si trattasse di alcune settimane. Sebbene non abbiamo prove indiscutibili sull'affidabilità di tali attestati, possiamo avanzare un'ipotesi per spiegare i diversi fenomeni. Nel primo caso, le sostanze inquinanti contenute nel farmaco hanno raggiunto il cervello e, a seconda del sito anatomico interessato, hanno indotto una reazione. In tal caso, l'intero fenomeno è molto rapido. In quest'ultima circostanza, le sostanze inquinanti hanno raggiunto il microbiota, interferendo così con la produzione di enzimi necessari per svolgere le funzioni neurologiche [32-35]. Tale possibilità richiede tempo, poiché comporta la produzione di composti chimici in quantità sufficiente ed è ragionevole un intervallo di alcune settimane tra l'iniezione e l'evidenza clinica. Certo, la nostra non è altro che un'ipotesi aperta alla discussione e bisognosa di prove, nella speranza che sia consentita un'ulteriore indagine.
La quantità di corpi estranei rilevati e, in alcuni casi, le loro insolite composizioni chimiche ci hanno sconcertato. Le particelle inorganiche identificate non sono né biocompatibili né biodegradabili, ciò significa che sono biopersistenti e possono indurre effetti che possono diventare evidenti o immediatamente vicini al tempo di iniezione o dopo un certo tempo dalla somministrazione. È importante ricordare che le particelle (cristalli e non molecole) sono corpi estranei all'organismo e si comportano come tali. Più in particolare, la loro tossicità è per alcuni aspetti diversa da quella degli elementi chimici che li compongono, aggiungendo a quella tossicità che, in ogni caso, è ancora presente, quella tipica di corpi estranei. Per tale motivo, inducono una reazione infiammatoria.
Dopo l'iniezione, tali microparticelle, nanoparticelle e aggregati possono rimanere attorno al sito di iniezione formando gonfiori e granulomi [17]. Ma possono anche essere trasportati dalla circolazione sanguigna, sfuggendo a qualsiasi tentativo di indovinare quale sarà la loro destinazione finale. Riteniamo che in molti casi si distribuiscano in tutto il corpo senza causare alcuna reazione visibile, ma è anche probabile che, in alcune circostanze, raggiungano un certo organo, nessuno escluso, incluso il microbiota, in discrete quantità. Come accade con tutti i corpi estranei, in particolare quelli piccoli, inducono una reazione infiammatoria cronica perché la maggior parte di quelle particelle non può essere degradata. Inoltre, l'effetto proteina-corona (dovuto a una nano-bio-interazione [18]) può produrre particelle composite organiche / inorganiche in grado di stimolare il sistema immunitario in modo indesiderato [19-22]. È impossibile non aggiungere che particelle delle dimensioni spesso osservate nei vaccini possono entrare nei nuclei cellulari e interagire con il DNA [23].
In alcuni casi, ad esempio come accade con il ferro e alcune leghe di ferro, possono corrodersi e i prodotti di corrosione esercitano una tossicità per i tessuti [24-26].
Il rilevamento della presenza di sali di alluminio e NaCl è ovvio in quanto sono sostanze utilizzate dai produttori e dichiarate come componenti, ma non si suppone che altri materiali siano presenti nel vaccino o in qualsiasi altro farmaco iniettabile, e, in ogni caso , L'alluminio è già stato associato a malattie neurologiche [27-29].
Date le contaminazioni che abbiamo osservato in tutti i campioni di vaccini per uso umano, gli effetti negativi dopo l'iniezione di tali vaccini sono possibili e credibili e hanno il carattere di casualità, poiché dipendono da dove i contaminanti sono trasportati dalla circolazione sanguigna. È ovvio che quantità simili di questi corpi estranei possono avere un impatto più grave su organismi molto piccoli come quelli dei bambini. La loro presenza nei muscoli, a causa di uno stravaso dal sangue, potrebbe compromettere pesantemente la funzionalità muscolare [30,31].
Incontriamo particelle con composizioni chimiche, simili a quelle trovate nei vaccini che abbiamo analizzato, quando studiamo casi di contaminazione ambientale causati da diverse fonti di inquinamento. Nella maggior parte dei casi, le combinazioni rilevate sono molto strane in quanto non hanno un uso tecnico, non possono essere trovate in nessun manuale del materiale e sembrano il risultato della formazione casuale che si verifica, ad esempio, quando i rifiuti vengono bruciati. In ogni caso, qualunque sia la loro origine, non dovrebbero essere presenti in alcun medicinale iniettabile, figuriamoci nei vaccini, più in particolare quelli destinati ai bambini.
Altre forme di contaminazioni finora sconosciute sono state recentemente osservate e, in ogni caso, i vaccini contengono componenti che potrebbero a loro volta essere la causa di effetti avversi. È un fatto ben noto in tossicologia che i contaminanti esercitano un effetto reciproco e sinergico e quando il numero di contaminanti aumenta, gli effetti diventano sempre meno prevedibili. Tanto più quando alcune sostanze sono sconosciute.
È un dato di fatto, non esistono dati ufficiali esaustivi e affidabili sugli effetti collaterali indotti dai vaccini. Le prove episodiche riportate da persone presumibilmente danneggiate dai vaccini sono duplici: alcuni sostengono che il danno si sia verificato e sia diventato visibile entro poche ore dalla somministrazione, e alcuni sostengono che si trattasse di alcune settimane. Sebbene non abbiamo prove indiscutibili sull'affidabilità di tali attestati, possiamo avanzare un'ipotesi per spiegare i diversi fenomeni. Nel primo caso, le sostanze inquinanti contenute nel farmaco hanno raggiunto il cervello e, a seconda del sito anatomico interessato, hanno indotto una reazione. In tal caso, l'intero fenomeno è molto rapido. In quest'ultima circostanza, le sostanze inquinanti hanno raggiunto il microbiota, interferendo così con la produzione di enzimi necessari per svolgere le funzioni neurologiche [32-35]. Tale possibilità richiede tempo, poiché comporta la produzione di composti chimici in quantità sufficiente ed è ragionevole un intervallo di alcune settimane tra l'iniezione e l'evidenza clinica. Certo, la nostra non è altro che un'ipotesi aperta alla discussione e bisognosa di prove, nella speranza che sia consentita un'ulteriore indagine.
Conclusione
Le analisi effettuate mostrano che in tutti i campioni i vaccini controllati contengono corpi estranei non biocompatibili e bio-persistenti che non sono dichiarati dai produttori, nei confronti dei quali l'organismo reagisce in ogni caso. Questa nuova indagine rappresenta un nuovo controllo di qualità che può essere adottato per valutare la sicurezza di un vaccino. La nostra ipotesi è che questa contaminazione non è intenzionale, poiché è probabilmente dovuta a componenti o procedure inquinate di processi industriali (ad es. Filtrazioni) utilizzate per produrre vaccini, non studiate e non rilevate dai produttori. Se la nostra ipotesi è effettivamente il caso, un'attenta ispezione dei luoghi di lavoro e la piena conoscenza dell'intera procedura di preparazione del vaccino probabilmente consentirebbero di eliminare il problema.
Un'ulteriore purificazione dei vaccini potrebbe migliorare la loro qualità e probabilmente ridurre il numero e la gravità degli effetti collaterali avversi.
Le analisi effettuate mostrano che in tutti i campioni i vaccini controllati contengono corpi estranei non biocompatibili e bio-persistenti che non sono dichiarati dai produttori, nei confronti dei quali l'organismo reagisce in ogni caso. Questa nuova indagine rappresenta un nuovo controllo di qualità che può essere adottato per valutare la sicurezza di un vaccino. La nostra ipotesi è che questa contaminazione non è intenzionale, poiché è probabilmente dovuta a componenti o procedure inquinate di processi industriali (ad es. Filtrazioni) utilizzate per produrre vaccini, non studiate e non rilevate dai produttori. Se la nostra ipotesi è effettivamente il caso, un'attenta ispezione dei luoghi di lavoro e la piena conoscenza dell'intera procedura di preparazione del vaccino probabilmente consentirebbero di eliminare il problema.
Un'ulteriore purificazione dei vaccini potrebbe migliorare la loro qualità e probabilmente ridurre il numero e la gravità degli effetti collaterali avversi.
Riconoscimento
Gli autori sono in debito con la dott.ssa Federico Capitani, la dott.ssa Laura Valentini e la sig.ra Lavinia Nitu per la loro assistenza tecnica. Le opinioni e le conclusioni non sono necessariamente quelle dell'istituzione.
Riferimenti
- Healthy Children.org
- Aggiornamento del rapporto Dipartimento di salute e servizi umani degli Stati Uniti (1996): Effetti collaterali dei vaccini, reazioni avverse, controindicazioni e precauzioni. CDC 45 (RR-12): 1-35.
- Ottaviani G, Lavezzi AM, Matturri L (2006) Sindrome da morte improvvisa infantile (SIDS) poco dopo la vaccinazione esavalente: patologia nel sospetto SIDS? Virchows Arch 448 (1): 100-104.
- Taylor B, Miller E, Farrington CP, Petropoulos MC, Favot-Mayaud I, et al. (1999) Autismo e vaccino contro il morbillo, la parotite e la rosolia: nessuna evidenza epidemiologica per un'associazione causale. Lancetta 353 (9169): 2026-2029.
- Demicheli V, Rivetti A, Debalini MG, Di Pietrantonj C (2012) Vaccini per morbillo, parotite e rosolia nei bambini. Cochrane Database Syst Rev 15 (2): CD004407.
- Carola Bardage, Ingemar Persson, Åke Örtqvist, Ulf Bergman, Jonas F Ludvigsson, et al. (2011) Disturbi neurologici e autoimmuni dopo la vaccinazione contro l'influenza pandemica A (H1N1) con un vaccino adiuvato monovalente: studio di coorte basato sulla popolazione a Stoccolma, Svezia. BMJ 343: d5956.
- Johann Liang R (2012) Aggiornamento della tabella delle lesioni da vaccino a seguito del rapporto IOM del 2011 sugli effetti avversi dei vaccini. HRSA, pagg. 1-27.
- L Tomljenovic, CA Shaw (2011) Coadiuvanti del vaccino in alluminio: sono sicuri? Chimica medicinale attuale 18 (17): 2630-2637.
- Shaw CA, Petrik MS (2009) Le iniezioni di idrossido di alluminio portano a deficit motori e degenerazione dei motoneuroni. J Inorg Biochem 103 (11): 1555-1562.
- Authier FJ, Sauvat S, Christov C, Chariot P, Raisbeck G, et al. (2006) La miofasciite macrofagica indotta da vaccino con AlOH3 nei ratti è influenzata dal background genetico. Neuromuscul Disord 16 (5): 347-352.
- Exley C, Esiri MM (2006) Una grave angiopatia congofila cerebrale coincide con un aumento dell'alluminio cerebrale in un residente di Camelford, Cornwall, Regno Unito. J Neurol Neurosurg Psychiatry 77 (7): 877-879.
- Wills MR, Savory J (1985) Contenuto d'acqua di alluminio, demenza da dialisi e osteomalacia. Environ Health Perspect 63: 141-147.
- Brinth L, Pors K, Theibel AC, Mehlsen J (2015) Sospetti effetti collaterali del vaccino quadrivalente per papilloma umano. Danish Medical J 62 (4): 1-12.
- Palmieri B, Poddighe D, Vadalà M, Laurino C, Carnovale C, et al. (2016) Grave somatoforma e sindromi disautonomiche dopo la vaccinazione HPV: serie di casi e revisione della letteratura. Immunol Res.
- Visani G, Manti A, Valentini L, Canonico B, Loscocco F, et al. (2016) Le nanoparticelle ambientali sono significativamente sovraespresse nella leucemia mieloide acuta. Leuk Res 50: 50-56.
- Artoni E, Sighinolfi GL, Gatti AM, Sebastiani M, Colaci M, et al. (2016) Micro e nanoparticelle come possibili cofattori patogenetici nella crioglobulinemia mista. Medicina del lavoro.
- T Hansen, L Klimek, F Bittinger, I Hansen, A Gatti, et al. (2008) Reiches dei mastociti Granuloma di alluminio Pathologe 29 (4): 311-313.
- Gatti AM, Manti A, Valentini L, Montanari S, Gobbi P, et al. (2016) Nano biointerazione del particolato nella circolazione sanguigna. Frontiers 30: 3.
- Tenzer S, Docter D, Rosfa S, Wlodarski A, Kuharev J, et al. (2011) La dimensione delle nanoparticelle è un determinante fisico-chimico critico della corona del plasma sanguigno umano: un'analisi proteomica quantitativa completa. ACS Nano 5 (9): 7155-167.
- Radauer Preiml, Andosch A, Hawranek T, Luetz-Meindl U, Wiederstein M, et al. (2015) Le interazioni nanoparticelle-allergeni mediano le risposte allergiche umane: caratterizzazione della corona proteica e risposte cellulari. Tossicologia delle fibre 13: 3.
- Cedervall T, Lynch I, Lindman S, Berggård T, Thulin E, et al. (2016) Comprensione della corona di nanoparticelle e proteine utilizzando metodi per quantificare i tassi di cambio e le affinità delle proteine per le nanoparticelle. PNAS 104 (7): 2050-2055.
- Lynch I, Cedervall T, Lundqvist M, Cabaleiro-Lago C, Linse S, et al. (2007) Il complesso nanoparticellare-proteina come entità biologica; una complessa sfida per i fluidi e le scienze superficiali per il 21 ° secolo. Progressi nella scienza colloidale e dell'interfaccia 134-135: 167-174.
- Gatti AM, Quaglino D, Sighinolfi GL (2009) Un approccio morfologico per monitorare l'interazione cellula-nanoparticella. International Journal of Imaging and Robotics 2: 2-21.
- Urban RM, Jacobs JJ, Gilbert JL, Galante JO (1994) Migrazione di prodotti corrosivi da protesi d'anca modulari. Microanalisi delle particelle e reperti istopatologici. The Journal of Bone and Joint Surgery 76 (9): 1345-1359.
- Kirkpatrick CJ, Barth S, Gerdes T, Krump-Konvalinkova V, Peters (K 2002) Pathomechanisms of alterata guarigione della ferita da prodotti di corrosione metallica. Mund Kiefer Gesichtschir 6 (3): 183-190.
- Lee SH, Brennan FR, Jacobs JJ, Urban RM, Ragasa DR, et al. (1997) Risposta di monociti / macrofagi umani ai prodotti di corrosione da cobalto-cromo e particelle di titanio in pazienti con protesi articolari totali. J Orthop Res 15 (1): 40-49.
- Shaw CA, Seneff S, Kette SD, Tomljenovic L, Oller Jr JW, et al. (2014) Entropia indotta dall'alluminio nei sistemi biologici: implicazioni per la malattia neurologica. Journal of Toxicology 2014: 491316.
- Shaw CA, Kette SD, Davidson RM, Seneff S (2013) Il ruolo di Aluminium nelle interazioni del sistema immunitario del sistema nervoso centrale che portano a disturbi neurologici. Immunome Research 9: 069.
- Seneff S, Swanson N, Chen Li (2015) L'alluminio e il glifosato possono indurre sinergicamente la patologia della ghiandola pineale: connessione alla disbiosi intestinale e alla malattia neurologica. Scienze agrarie 6 (1): 42-70.
- Pegaz B, Debefve E, Ballini JP, Konan-Kouakou YN, van den Bergh HJ (2006) Effetto della dimensione delle nanoparticelle sugli stravasi e sull'attività fototrombica della porfirina meso (p-tetracarbossifenil). J Photochem Photobiol B 85 (3): 216-222.
- Brinth LS, Pors K, Hoppe AG, Badreldin I, Mehlsen J (2015) La sindrome da affaticamento cronico / encefalomielite mialgica è una diagnosi rilevante nei pazienti con sospetti effetti collaterali del vaccino contro il papilloma umano? International Journal of Vaccines and Vaccination 1 (1): 1-5.
- Moos WH, Faller DV, Harpp DN, Kanara I, Pernokas J, et al. (2016) Microbiota e disturbi neurologici: una sensazione intestinale. Biores Open Access 5 (1): 137-145.
- Sekirov I, Russell SL, Caetano L, Antunes M, Brett (2010) Gut Microbiota in Health and Disease. Physiological Rev 90 (3): 859-904.
- Umbrello G, Esposito S (2016) Microbiota e malattie neurologiche: potenziali effetti dei probiotici. J Transl Med 14 (1): 298.
- Kinoshita T, Abe RT, Hineno A, Tsunekawa K, Nakane S, et al. (2014) Disfunzione del nervo simpatico periferico in ragazze adolescenti giapponesi a seguito di immunizzazione con il vaccino papillomavirus umano. Intern Med 53 (19): 2185-2200.
© 2017 Gatti, et al. Questo è un articolo ad accesso aperto distribuito secondo i termini della Licenza di attribuzione Creative Commons , che consente l'uso, e la distribuzione senza restrizioni del lavoro non commerciale.

© 2017 Gatti, et al. Questo è un articolo ad accesso aperto distribuito secondo i termini della Licenza di attribuzione Creative Commons , che consente l'uso, e la distribuzione senza restrizioni del lavoro non commerciale.





Nessun commento:
Posta un commento